Calendrier scientifique Juillet 2018
Quelle est la différence entre la lyse et les procédures de coloration standardisée des globules blancs dans les canaux WDF et WPC?
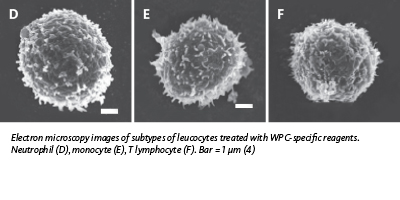
Le réactif de lyse utilisé dans le canal WPC est plus puissant sur les lipides membranaires. La durée d'incubation du surfactant est plus longue, le réactif de fluorescence présente une concentration plus forte en polyméthine et l'ADN du noyau est marqué dans le canal WPC.
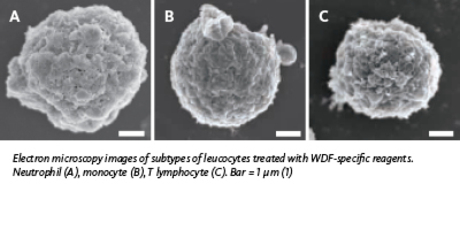
Le réactif de lyse utilisé dans le canal WDF est plus puissant sur les lipides membranaires. La durée d'incubation du surfactant est plus longue, le réactif de fluorescence présente une concentration plus forte en polyméthine et l'ADN du noyau est marqué dans le canal WDF.
Le réactif de lyse utilisé dans le canal WPC est plus puissant sur les lipides membranaires. La durée d'incubation du surfactant est plus longue, le réactif de fluorescence présente une concentration plus faible en polyméthine et l'ARN du cytoplasme est marqué dans le canal WPC.
Le réactif de lyse utilisé dans le canal WDF est plus puissant sur les lipides membranaires. La durée d'incubation du surfactant est plus courte, le réactif de fluorescence présente une concentration plus forte en polyméthine et l'ADN du noyau est marqué dans le canal WDF.
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Informations scientifiques de base
Le fait de combiner l'analyse des canaux WDF et WPC en utilisant la cytométrie en flux par fluorescence au sein d'un seul analyseur nous permet de détecter les cellules cancéreuses et réactives de façon sensible et spécifique. C'est possible en tirant parti des différences de fonctionnalité cellulaire des divers globules blancs.
Dans le canal d'analyse différentielle des globules blancs (White Blood Cell Differential – WDF), le marquage par fluorochrome dépend de la composition de la membrane et du contenu cytoplasmique des globules blancs. La membrane lipidique des cellules activées ou immatures se distingue par sa composition de celle des cellules non réactives et matures. Une combinaison unique de réactifs (lyse et marquage) et de durée d'incubation permet de séparer les différentes populations cellulaires. Premièrement, le réactif de lyse perfore les membranes cellulaires, dans une mesure qui dépend de la composition en lipides, qui à son tour dépend du type cellulaire (niveau de maturité) et de l'état de la cellule (activé ou non). Ensuite, le fluorochrome marque essentiellement l'ARN dans le cytoplasme. L'intensité du signal de fluorescence obtenu est liée à l'importance de la perforation de la membrane (composition lipidique) et à la quantité totale d'ARN dans le cytoplasme. Des algorithmes élaborés en interne analysent les informations concernant la composition membranaire et l'ARN cytoplasmique (fluorescence), le volume cellulaire (prodiffusion) et la structure intracellulaire (diffusion latérale), de façon à détecter de façon sensible les cellules réactives, immatures ou pathologiques dans un échantillon sanguin.
Le réactif de lyse utilisé dans le canal WPC est plus puissant sur les lipides membranaires en raison de la présence d'un surfactant différent et d'une plus longue durée d'incubation par rapport au canal WDF. Le réactif de fluorescence présente en plus une concentration plus forte en polyméthine, ce qui, par conséquent, marque l'ADN du noyau. La présence de ce qu'on appelle les « radeaux lipidiques » illustre par exemple la façon dont la composition en lipides de la membrane est affectée par la fonctionnalité ou l'activation d'une cellule. Ces radeaux lipidiques sont des microdomaines riches en cholestérol et en glycosphingolipides, situés dans les membranes plasmiques de la cellule et qui jouent un rôle important dans les échanges de protéines et la voie de signalisation cellulaire. Ces radeaux sont plus ordonnés et compacts que la bicouche qui les entoure et dans laquelle ils flottent librement. Un pourcentage élevé de radeaux lipidiques est rapporté dans la membrane des cellules plus actives dans la communication extracellulaire (par ex. dans les cellules cancéreuses et matures activées) par rapport aux cellules matures au repos ou aux cellules immatures (2-3).
La perméabilisation plus grande de certains types de cellules, tels que les lymphocytes anormaux, entraine une perte cytoplasmique, donc une réduction de la taille de la cellule (signal de prodiffusion). Par conséquent, alors que le canal WDF suggère essentiellement une activité cytoplasmique, le canal WPC détecte les cellules anormales à partir de la composition de leur membrane, ce qui permet de différencier les tailles (réduction de certains types de cellules) et un meilleur accès à l'ADN contenu, qui se trouve marqué avec plus d'intensité.
Il est possible d'optimiser la sensibilité et la spécificité de la détection des cellules cancéreuses et réactives en combinant les deux canaux, donc leurs ensembles de réactifs et conditions de réaction.
Références
- Kawauchi S et al. (2014): Comparison of the Leukocyte Differentiation Scattergrams Between the XN-Series and the XE-Series of Hematology Analyzers. Sysmex Journal International Vol.24 No.1.
- Tuosto L et al. (2001): Organization of plasma membrane functional rafts upon T cell activation. Eur J Immunol. 31(2): 345 – 9.
- Li YC et al. (2006): Elevated Levels of Cholesterol-Rich Lipid Rafts in Cancer Cells Are Correlated with Apoptosis Sensitivity Induced by Cholesterol-Depleting Agents. Am J Pathol. 168(4): 1107 – 18.
- Kawauchi S et al. (2013): The Position of Normal Leukocytes on the Scattergram of the Newly Developed Abnormal Cell-detection Channel of the XN-Series Multi-parameter Automated Hematology Analyzers. Sysmex Journal International Vol.23 No.1.